Der Mensch ist ein Mischwesen, ein „Superorganismus“, meint der US-amerikanische Genetiker und Nobelpreisträger Joshua Lederberg.
Der Mensch ist ein Mischwesen, ein „Superorganismus“, meint der US-amerikanische Genetiker und Nobelpreisträger Joshua Lederberg.
Die Gesamtzahl der Bakterien in unserem Darm wird auf 100 Billionen (1014) geschätzt. Das sind 10-mal mehr Bakterien als menschliche Körperzellen und das gesamte Erbgut der Bakterien enthält 100-mal mehr Gene, als das gesamte menschliche Erbgut.1
Der Großteil der Bakterien schadet uns nicht, sondern leistet uns sogar unverzichtbare Hilfe, in dem er z. B. bei der Verdauung der Nahrung hilft, Vitamine produziert und die Epithelzellen der Darmwand ernährt.
Wir leben also in einem kooperativen Miteinander mit den Bakterien – in einer Art Waffenruhe.
Bei Morbus Crohn und Colitis ulcerosa ist diese Waffenruhe jedoch aufgehoben und das Immunsystem richtet sich gegen die Bakterien der Darmflora.
Im Moment geht die Wissenschaft davon aus, dass chronische Darmentzündungen durch eine zu aggressive Reaktion des Immunsystems auf natürliche Darmbakterien bei genetisch anfälligen Personen ausgelöst werden.2
In diesem Artikel möchte ich zeigen, welche Rolle die Darmflora bei CED spielt, und wie man mit der Einnahme von Probiotika die Darmflora und dadurch die chronische Entzündung bei Morbus Crohn und Colitis ulcerosa positiv beeinflussen kann.
Inhaltsverzeichnis
Die Bedeutung der Darmflora bei chronischen Darmentzündungen
Mit der Zeit haben immer mehr Hinweise aus der Behandlung von CED-Patienten und experimentellen Studien darauf hingedeutet, dass die Darmbakterien eine wichtige Rolle bei der Entstehung von Morbus Crohn und Colitis ulcerosa spielen.
Folgende Dinge konnte man dabei beobachten:3
- Bei Tierversuchen mit Mäusen und Ratten, die aufgrund von Gendefekten anfällig für eine CED waren, brach die Entzündung nur dann aus, wenn der Darm mit Bakterien besiedelt war. Wurden die Versuchstiere dagegen keimfrei aufgezogen, blieben sie entzündungsfrei.
- Die Entzündung entsteht bei MC, CU und Pouchitis in den Darmabschnitten, wo die meisten Bakterien leben.
- Bei MC, CU und Pouchitis ist die Zusammensetzung der Darmflora anders, als bei gesunden Menschen.
- Bei MC sind vermehrt krankmachende Stämme von E. coli-Bakterien im Darm vorhanden.
- Die veränderte Darmflora bei MC, CU und Pouchitis kann zur Produktion von vorteilhaften oder nachteiligen Stoffwechselprodukten führen: Zum Beispiel gibt es auf der einen Seite Bakterienstämme, die Butyrat und andere kurzkettige Fettsäuren (SCFA) produzieren, welche die bevorzugte Energiequelle für die Epithelzellen der Darmwand sind und auf der anderen Seite gibt es schwefelreduzierende Bakterienstämme, welche die Verwendung von Butyrat als Energiequelle blockieren.
- Bei CED-Patienten, in erster Linie bei MC, ist die Zahl der Darmbakterien im Schub dramatisch erhöht.
- Bei MC und CU dringen im Schub vermehrt Bakterien in die Darmwand ein oder gelangen durch die Darmwand hindurch in den Rest des Körpers.
- Bei MC können Gene verändert sein, die für die Erkennung und den Umgang mit Bakterien wichtig sind.
- Wenn bei MC und Pouchitis, z. B. durch die Anlage eines künstlichen Darmausgangs (Stoma), die entzündeten Darmabschnitte nicht mehr mit Stuhl in Berührung kommen, klingt die Entzündung dort ab. Wird der Darmabschnitt wieder „in Betrieb“ genommen, kehrt auch die Entzündung wieder zurück.
- Bei MC, CU und Pouchitis sind mehr Antikörper und T-Zellen vorhanden, die gegen Antigene von Bakterien gerichtet sind.
- Antibiotika helfen vor allem bei MC und Pouchitis, aber auch bei CU.
Aufgrund dieser vielen Hinweise hat man weiter geforscht und entdeckt, dass es im Zusammenspiel zwischen Darmflora und Immunsystem 4 Mechanismen gibt, die zur Entstehung und Aufrechterhaltung von chronischen Darmentzündungen beitragen.
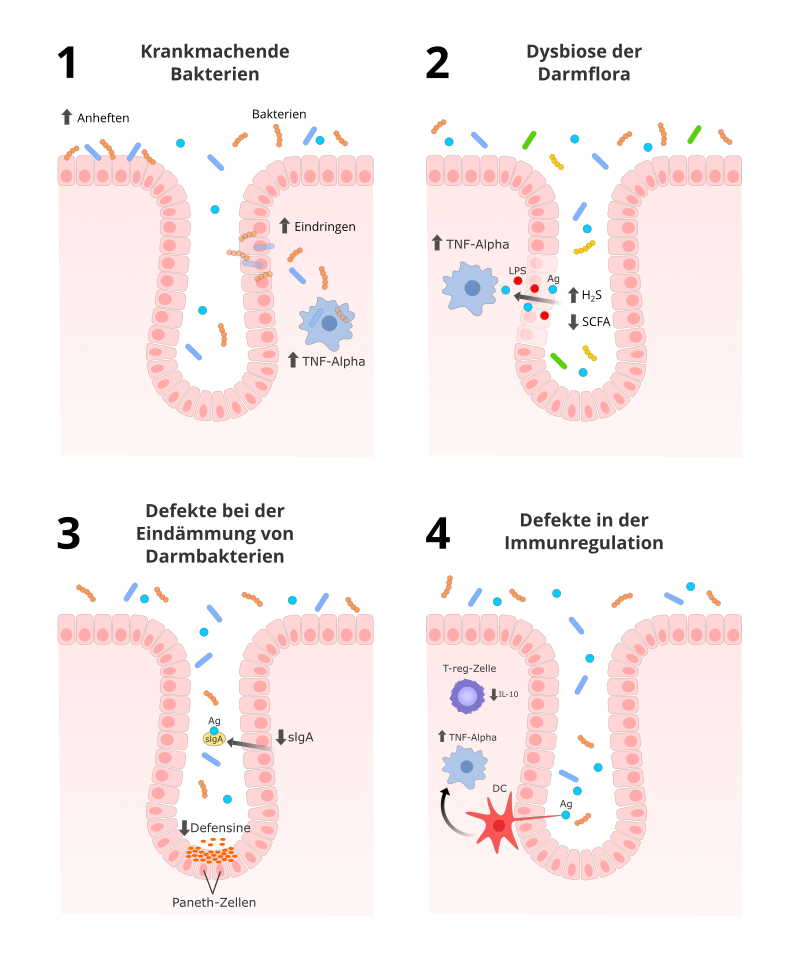
In der folgenden Abbildung sind diese 4 Mechanismen vereinfacht dargestellt.
Im ersten Fall sind es krankmachende Bakterien oder veränderte Bakterien der Darmflora, die zum Problem werden.
So kann z. B. der Durchfall-Erreger Mycobacterium paratuberculosis über Milchprodukte, Fleisch oder ungewaschenes Gemüse in den Darm gelangen und vermutlich bei einer entzündlichen Vorerkrankung, wie Morbus Crohn oder Colitis ulcerosa, durch die „aufgeriebene“ Darmwand eindringen und die Krankheit verschlimmern.4
Darüber hinaus wird vermutet, dass bei einigen Morbus Crohn-Patienten das Immunsystem nicht richtig auf die normalen Darmbakterien reagiert.
So entsteht ein Entzündungsmillieu, das es bestimmten E. coli-Bakterien (AIEC = adherent-invasive E. coli) einfacher macht, sich an die Darmwand zu heften oder durch die Darmwand hindurchzudringen. Im Körper heizen diese E. coli-Bakterien die Entzündung dann weiter an.5
Auf der zweiten Abbildung sieht man, dass auch eine veränderte Darmflora (Dysbiose) die Entzündung im Darm fördern kann.
Es gibt z. B. Darmbakterien, die Ballaststoffe in kurzkettige Fettsäuren (SCFA) umwandeln, die eine wichtige Energiequelle für die Epithelzellen der Darmwand sind.
Essen wir zu wenig Ballaststoffe oder haben wir zu wenige Bakterien im Darm, die daraus kurzkettige Fettsäuren produzieren, wird unsere Darmwand durchlässiger. Dadurch können Bakteriengifte (LPS) und Antigene (Ag) in den Körper eindringen und die Produktion von Entzündungsbotenstoffen, wie TNF-α, anheizen.
Darüber hinaus kann auch die Konzentration von ungünstigen Bakterien ansteigen: Sie produzieren aggressive Stoffwechselprodukte, wie z. B. Schwefelwasserstoff (H2S), der auch die Darmwand durchlässiger macht.
Da Schwefelwasserstoff bei der Verdauung von Proteinen entsteht, ist es wahrscheinlich ungünstig für unsere Darmflora, wenn wir zu viel proteinreiche Nahrung, wie Fleisch, Milchprodukte und Eier, essen.
Die dritte Abbildung zeigt, was bei CED passiert, wenn die Eindämmung der Darmbakterien nicht mehr richtig funktioniert.
Normalerweise produzieren die Paneth-Zellen am Grund der Epithelzellen der Darmwand antimikrobielle Peptide, so genannte Defensine.
Das sind Eiweißstoffe, die die Zusammensetzung der Darmflora kontrollieren und verhindern dass Mikroorganismen in die Schleimhaut eindringen können und so Entzündungen auslösen.6
Bei Morbus Crohn-Patienten hat man festgestellt, dass aufgrund von Mutationen des NOD2-Gens weniger Defensine gebildet werden und dadurch die Verteidigung der Darmwand nicht mehr gewährleistet ist.
Eine weitere wichtige Rolle bei der Eindämmung der Darmbakterien spielt der Antikörper Immunglobulin A (lgA).
Als sekretorisches lgA (slgA) in den Schleimhäuten der Darmwand, bildet es eine wichtige Abwehrbarriere gegen Krankheitserreger.
Forscher haben festgestellt, dass Babys mit einem höheren Anteil an Bifidobakterien im Stuhl auch eine höhere Konzentration des Antikörpers slgA in der Schleimhaut haben.24
Siedeln sich direkt nach der Geburt günstige Bakterien im Darm an, wird also vermutlich auch die Abwehrbarriere in der Darmwand stabiler.
Geschieht das nicht, weil das Baby z. B. nicht gestillt wird, kann das vermutlich zu einer schwächeren Darmbarriere und dadurch zu einer chronischen Darmentzündung im späteren Leben führen.
Auf der vierten Abbildung sieht man, wie eine Fehlfunktion von Immunzellen eine chronische Darmentzündung begünstigen kann.
Die sternförmigen, dendritischen Zellen (rot) sind die Wachposten und Alarmgeber des Immunsystems. Sie strecken ihre Ausläufer durch die Darmwand in den Darm hinein und suchen so das Darminnere nach Antigenen, z. B. von Bakterien, ab.
Diese Antigene präsentieren sie dann den T-Zellen des Immunsystems, die dann die notwendigen Entzündungsbotenstoffe produzieren, damit der Eindringling bekämpft werden kann.
Wenn diese Antigenpräsentation verändert ist, kann es sein, dass zu viele entzündungsfördernde Botenstoffe produziert werden und die Entzündungsreaktion zu stark wird und die Darmwand beschädigt.
Normalerweise sorgt eine spezialisierte Untergruppe der T-Zellen, die regulatorischen T-Zellen (blau), dafür, dass die Entzündungsreaktion nicht aus dem Ruder läuft. Sie unterdrücken das Immunsystem durch die Freisetzung entzündungshemmender Botenstoffe, wie IL-10, und verhindern dadurch die Entstehung von Autoimmunerkrankungen, wie Morbus Crohn und Colitis ulcerosa.
Ob die regulatorischen T-Zellen ihre Aufgabe richtig erfüllen, hängt auch wiederum von der Zusammensetzung der Darmflora ab. Nur bei einer gesunden Darmflora lernen die Immunzellen auf gefährliche Fremdkörper zu reagieren und gleichzeitig die dadurch ausgelöste Entzündung im Zaum zu halten.
Da man erkannt hat, wie wichtig die Darmflora bei CED ist, hat man eine Menge Studien zur Wirksamkeit von Probiotika bei Morbus Crohn, Colitis ulcerosa und Pouchitis durchgeführt.
Im folgenden Abschnitt stelle ich die wichtigsten Studien vor, in denen die Behandlung von CED-Patienten mit Probiotika erfolgreich war.
Was sind Probiotika?
Probiotika sind laut der Weltgesundheitsorganisation (WHO) lebende Organismen, die in geeigneter Menge verabreicht, gesundheitsfördernd auf den Wirt wirken.
Als Probiotika gelten Lactobacilli, Bifidobacteria, Streptococcus, Enterococcous, nicht pathogene E. coli sowie Saccharomyces boulardii.7
Damit ein Probiotikum „gesundheitsfördernd“ ist, muss es folgende Anforderungen erfüllen:
- Es muss menschlicher Herkunft sein,
- von der amerikanischen Food and Drug Administration (FDA) als sicher eingestuft sein,
- stabil gegenüber Magensäure und Galle sein,
- fähig sein, sich an die Epithelzellen der Darmwand anzuheften,
- einige Zeit im Magen-Darm-Trakt überleben,
- fähig sein, antimikrobielle Substanzen zu produzieren,
- gegen krankmachende Bakterien wirken und
- die Immunantwort des Wirtes modulieren.3
Schon vor fast 2.000 Jahren hat der römische Schriftsteller und Historiker Plinius der Ältere in dem Nachschlagewerk Naturalis historia (dt.: Naturgeschichte) den therapeutischen Einsatz von Nahrung beschrieben, die durch Mikroorganismen fermentiert wurde.2
1907 behauptete dann der Nobelpreisträger Elie Metchnikoff, dass der, in Joghurt enthaltene, Bakterienstamm Lactobacillus bulgaricus, in der Lage ist, krankmachende Bakterien im Darm zu verdrängen.
Der deutsche Arzt Alfred Nissle war der Erste, der 1917 einen probiotischen Bakterienstamm aus dem Stuhl eines Soldaten im 1. Weltkrieg isolierte, der gesund blieb, obwohl alle seine Kameraden unter Durchfall litten.
Mit diesem Probiotikum behandelte er dann auch eine Patientin mit einer chronischen Darmentzündung — das war das erste Mal, dass ein probiotischer Bakterienstamm zur Behandlung einer CED verwendet wurde.
Der nach ihm benannte Escherichia coli Stamm Nissle wird seitdem bis heute unter dem Markennamen Mutaflor vertrieben und zur Behandlung bei CED eingesetzt.
Probiotika bei Colitis ulcerosa
Die größten Erfolge bei der Probiotika-Behandlung von CED hat man bei Colitis ulcerosa gemacht. Vermutlich liegt das daran, dass sich der Großteil der Darmbakterien im Dickdarm befindet.
Hier ist eine Übersicht aller Studien, bei denen die Behandlung mit Probiotika bei Colitis ulcerosa erfolgreich war:
Da Colitis ulcerosa oft in Schüben verläuft, hat man untersucht, ob man mit Probiotika die schubfreie Zeit (Remission) erhalten kann und ob Probiotika im akuten Schub auch eine Remission herbeiführen können.
Besonders deutlich sind die Ergebnisse bei der Remissionserhaltung.
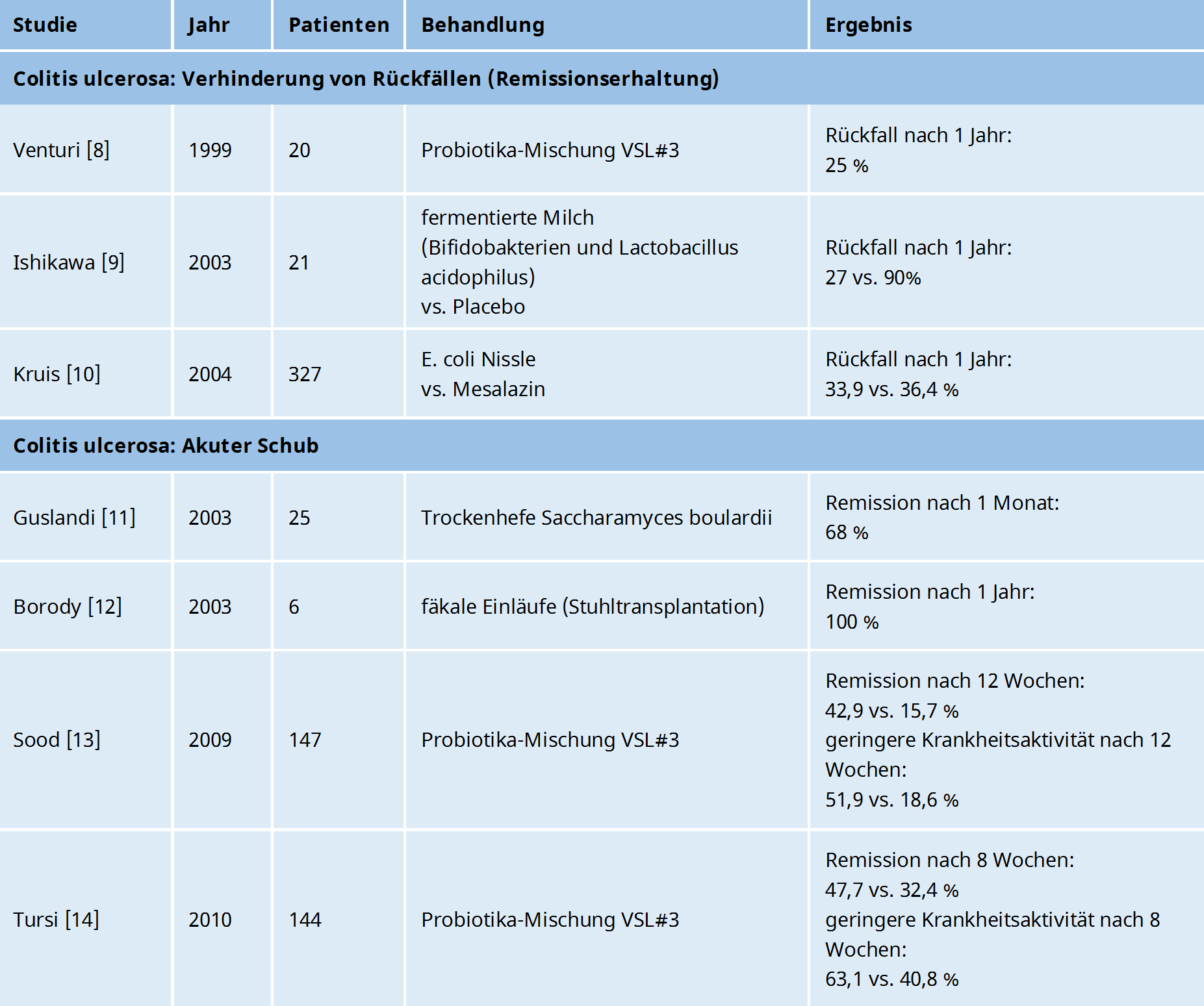
Probiotika zur Verhinderung von Rückfällen bei Colitis ulcerosa (Remissionserhaltung)
In einer großen Studie mit 327 Teilnehmern waren 200 mg des Bakterienstammes E. coli Nissle 1917 genauso effektiv in der Remissionserhaltung, wie die Behandlung mit 500 mg Mesalazin (3x täglich).10
Bei beiden Alternativen hatte nach 1 Jahr ca. ein Drittel der Colitis-Patienten einen Rückfall, d. h. ca. zwei Drittel waren immer noch in Remission.
Der Bakterienstamm E. coli Nissle 1917 wird auch heute noch unter dem Namen Mutaflor vertrieben und aufgrund der positiven Studien auch von einigen Gastroenterologen, als Alternative zu Mesalazin (Salofalk), verschrieben.
Wenn man als Colitis-Patient von dem Medikament Salofalk Nebenwirkungen bekommt oder anstatt eines Medikaments lieber ein natürliches Probiotikum einnehmen möchte, lohnt es sich also seinen Arzt auf die alternative Behandlung mit E. coli Nissle anzusprechen.
Neben E. coli Nissle hat man auch die Wirkung von anderen Probiotika-Stämmen auf die Remissionerhaltung bei Colitis untersucht.
Der Einsatz der Probiotika-Mischung VSL#3 führte dazu, dass nach 1 Jahr nur 25 % der Teilnehmer einen Rückfall erlitten.8
Leider gab es in dieser Studie keine Vergleichsgruppe, aber eine Rückfallquote von 25 % weist auf eine positive Wirkung von VSL#3 hin.
Auch die Behandlung mit Milch, die mit Bifidobakterien und Lactobacillus acidophilus fermentiert wurde, führte dazu, dass nach 1 Jahr nur 27 % der Teilnehmer einen Rückfall hatten.
In der Placebo-Gruppe, die keine fermentierte Milch erhielt, hatten dagegen 90 % nach 1 Jahr wieder einen Schub.9
Die beiden Studien mit dem Probiotikum VSL#3 und der fermentierten Milch waren zwar sehr klein, sind aber ein Hinweis darauf, dass nicht nur E. coli Nissle (Mutaflor), sondern auch andere Probiotika mit Lactobazillen und Bifidobakterien zur Remissionserhaltung bei Colitis ulcerosa beitragen können.
Probiotika zur Behandlung eines akuten Schubs bei Colitis ulcerosa
Die Studienergebnisse zur Behandlung eines akuten Schubs bei Colitis ulcerosa mit Probiotika zeigen, dass es einfacher ist damit einen Schub zu verhindern, als ihn zu stoppen.
Trotzdem gibt es auch hier Erfolge:
Von 25 Patienten, die 3x täglich 250 mg der Trockenhefe Saccharamyces boulardii einnahmen, waren nach 1 Monat 68 % in Remission.11
Dieser schnelle und positive Effekt hat mich überrascht, da es sich bei diesem Probiotikum nicht um Bakterien, sondern um Hefepilze handelt.
Der Hefepilz Saccharamyces boulardii ist z. B. in dem rezeptfreien Apothekenprodukt Perenterol forte enthalten.
Ich habe mal ein ähnliches Produkt mit dem Namen Perocur forte ausprobiert, das die verwandte Hefe Saccharomyces cerevisiae enthält.
Ich bin dadurch zwar nicht in Remission gekommen, aber ich musste schon 1 Tag nach der Einnahme deutlich seltener auf Toilette.
Da Perenterol forte und Perocur forte rezeptfrei in der Apotheke erhältlich sind, lohnt es sich vielleicht für den einen oder anderen es mal auszuprobieren.
Es ist nur wichtig zu wissen, dass die beiden Hefepilze eigentlich nur für die Behandlung von normalem Durchfall und zur Stabilisierung der Darmflora — während oder nach einer Antibiotika-Therapie — gedacht sind.
Trotzdem zeigt die Studie oben, dass sie auch bei Colitis ulcerosa wirken könnten.
Eine weitere Studie von 2003 zeigt, dass das Thema Stuhltransplantation nicht neu ist:
6 Patienten mit Colitis ulcerosa und immer wiederkehrenden, schweren Symptomen, erhielten täglich 5 Tage lang Einläufe mit Spenderstuhl von gesunden Spendern.12
Schon nach 1 Woche besserten sich die Symptome und nach 4 Monaten waren die Symptome bei allen Patienten vollständig verschwunden.
Die Patienten wurden zwischen 1 und 13 Jahren nach der Behandlung beobachtet und es konnte weder mit Blutuntersuchung, Dickdarmspiegelung oder Gewebeuntersuchung noch eine Colitis ulcerosa festgestellt werden.
Dieser überzeugende Erfolg zeigt, dass hier für die Zukunft eine Chance für Patienten mit Colitis ulcerosa liegen könnte, denn es wird weiter an diesem Thema geforscht.
Auch die Versuche mit dem Probiotikum VSL#3 machen Mut.
In 2 Studien mit insgesamt 291 Teilnehmern konnte bei Patienten, die VSL#3 einnahmen, deutlich öfter eine Remission herbeigeführt werden, als in der Kontrollgruppe, die ein Placebo bekam.
Bei der ersten Studie von 2009 waren nach 12 Wochen 42,9 % der Patienten in Remission, während es in der Placebogruppe nur 15,7 % waren.13
Darüber hinaus hatten auch deutlich mehr Patienten in der VSL#3-Gruppe (51,9 %) eine geringere Krankheitsaktivität, als in der Placebogruppe (18,6 %).
Bei der zweiten Studie von 2010 waren schon nach 8 Wochen 47,7 % der Patienten in Remission, während es in der Placebogruppe nur 32,4 % waren.14
Auch hier hatten deutlich mehr Patienten in der VSL#3-Gruppe (63,1 %) eine geringere Krankheitsaktivität, als in der Placebogruppe (40,8 %).
In beiden Studien hatten die Teilnehmer einen milden bis moderaten Colitis-Schub. Ob VSL#3 bei schweren Schüben genauso wirksam ist, wurde noch nicht getestet.
Trotzdem haben die sehr guten Ergebnisse der beiden Studien dazu geführt, dass die Wirksamkeit von VSL#3 bei der Behandlung eines Schubes bei Colitis ulcerosa auch in den Leitlinien der European Crohn’s and Colitis Organisation (ECCO) erwähnt wird.1
Probiotika bei Pouchitis
In Deutschland wird pro Jahr bei etwa 500 bis 800 Patienten mit chronisch-entzündlichen Darmerkrankungen der Dickdarm komplett entfernt (Kolektomie) und ein Pouch angelegt.
Ein Pouch (Beutel) ist ein künstlicher Mastdarm, der aus dem Dünndarmende erstellt wird und als Ersatz für den entfernten Dickdarm dient.
Dieser Pouch kann sich entzünden (Pouchitis) und da in den meisten Fällen Antibiotika gegen diese Entzündung helfen, geht man davon aus, dass die Bakterien im Pouch der Auslöser für die Entzündung sind.
Deshalb hat man in mehreren Studien geprüft, ob eine Behandlung mit „gesunden“ Darmbakterien eine Pouchitis verhindern oder stoppen kann.
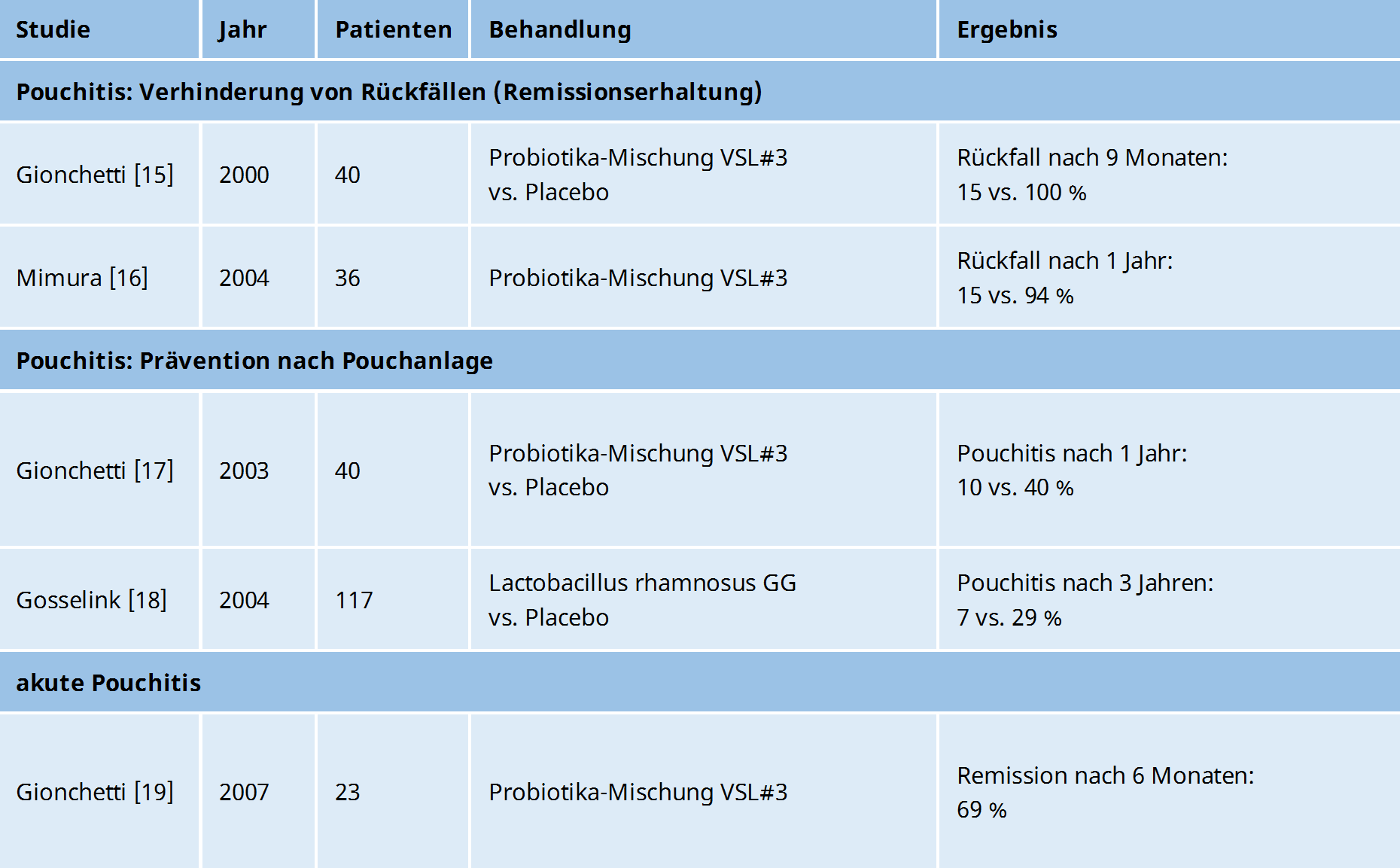
Probiotika zur Verhinderung von Rückfällen einer Pouchitis (Remissionserhaltung)
In einer Studie von 2000 mit 40 Patienten bekam die eine Hälfte 6 g VSL#3 (= 1,8 x 1012 Bakterien) pro Tag und die andere Hälfte ein Placebo.15
Innerhalb der nächsten 9 Monate bekamen nur 3 Patienten (15 %) in der VSL#3-Gruppe einen Rückfall, während sich in der Placebogruppe bei allen 20 Patienten (100 %) der Pouch wieder entzündete.
Diese deutlichen Ergebnisse wurden in einer Studie von 2004 bestätigt.16
Von 36 Patienten mit wiederkehrender oder chronischer Pouchitis wurde zunächst eine Remission mit Antibiotika herbeigeführt.
Danach bekamen 20 Patienten auch hier eine Dosis von 6 g VSL#3 (= 1,8 x 1012 Bakterien) und die restlichen 16 Patienten ein Placebo.
Im folgenden Jahr hatten auch in dieser Studie nur 3 Patienten (15 %) in der VSL#3-Gruppe einen Rückfall, während in der Placebogruppe fast alle (94 %), außer einem Patienten, einen Rückfall erlitten.
Die Ergebnisse legen also nahe, dass die Probiotika-Mischung VSL#3 Pouchitis-Rückfälle verhindern kann.
Probiotika zur Verhinderung einer Pouchitis nach der Pouchanlage (Primärprävention)
Da man Pouchitis-Rückfälle mit Probiotika verhindern kann, stellte sich natürlich die Frage, ob es nicht auch möglich wäre mit einer solchen Therapie zu verhindern, dass eine Pouchitis überhaupt erst entsteht.
Gionchetti und seine Kollegen, die im Jahre 2000 nachgewiesen hatten, dass VSL#3 Rückfälle bei Patienten mit chronischer Pouchitis verhindern kann, prüften deshalb im Jahre 2003, ob das Probiotikum auch hilft, wenn man es Patienten direkt nach der Pouchanlage gibt.17
Von 40 Colitis-Patienten, die gerade einen Pouch bekommen hatten, bekam die eine Hälfte 3 g VSL#3 (= 0,9 x 1012 Bakterien) und die andere Hälfte ein Placebo.
Im folgenden Jahr bekamen in der VSL#3-Gruppe nur 2 Patienten (10 %) eine Pouchitis, während es in der Placebogruppe 8 Patienten (40 %) waren.
Darüber hinaus gaben die Patienten in der VSL#3-Gruppe an, dass sich ihre Lebensqualität, mit durchschnittlich 2 Stühlen weniger am Tag, deutlich verbesserte. In der Placebogruppe war dies nicht der Fall.
Das Probiotikum VSL#3 kann laut der Autoren also auch das erste Auftreten einer Pouchitis nach der Pouchanlage verhindern.
Da diese Studie aber noch nicht von anderen Wissenschaflern bestätigt wurde, wird VSL#3 in den Leitlinien der gastroenterologischen Gesellschaften mehrerer Länder zwar für die Behandlung einer wiederkehrenden oder chronischen Pouchitis empfohlen, aber noch nicht für die Verhinderung einer Pouchitis direkt nach der Pouchanlage.
2004 wurde eine Studie veröffentlicht, die untersuchte, ob der Bakterienstamm Lactobacillus rhamnosus GG das erste Auftreten einer Pouchitis nach der Pouchanlage verhindern kann.18
Von 117 Patienten erhielten 39 direkt nach der Pouchanlage ein fermentiertes Produkt mit dem Probiotika-Stamm Lactobacillus rhamnosus GG, während der Rest nichts bekam.
Bei den Patienten in der Probiotika-Gruppe trat in den folgenden 3 Jahren deutlich seltener (7 %) das erste Mal eine Pouchitis auf, als in der nicht behandelten Gruppe (29 %).
Die Autoren der Studie empfehlen aufgrund der Ergebnisse die tägliche Einnahme von Lactobacillus rhamnosus GG um das erste Auftreten einer Pouchitis zu verzögern. Als Dosis empfehlen sie 1010 (= 10 Milliarden) Bakterien, 1-2x am Tag.
Auch hier gibt es keine offizielle Empfehlung, da noch weitere Studien fehlen.
Da die Wirksamkeit des Probiotikums VSL#3 insgesamt deutlich besser belegt ist und auch darin Lactobacillus-Stämme enthalten sind, ist VSL#3 die erste Wahl um eine Pouchitis zu verhindern.
Probiotika zur Behandlung einer akuten Pouchitis
Auch bei der Behandlung einer akuten Pouchitis testeten die Forscher um Gionchetti die Wirksamkeit von VSL#3.
In der 2007 veröffentlichten Studie wurden 23 Patienten mit einer milden Pouchitis mit einer Hochdosis von 2x 2 Packungen VSL#3 DS (= 3,6 x 1012 Bakterien) pro Tag für 4 Wochen behandelt. Alle Patienten, die nach 4 Wochen in Remission waren, bekamen für die restlichen 5 Monate 2x 1 Packung VSL#3 DS (= 1,8 x 1012 Bakterien) pro Tag.19
Nach 6 Monaten waren 69 % der Patienten in Remission.
Die Autoren kamen deshalb zu dem Schluss, dass eine hohe Dosis des Probiotikums VSL#3 bei der Behandlung der milden Pouchitis wirksam ist.
Probiotika bei Morbus Crohn
Im Gegensatz zu Colitis ulcerosa und Pouchitis gibt es bei Morbus Crohn nur wenige Studien, die eine Wirksamkeit von Probiotika zeigen und relativ viele bei denen Probiotika nicht effektiv waren.
Wahrscheinlich liegt das daran, dass Morbus Crohn meist den fast sterilen Dünndarm befällt, in dem fast keine Darmbakterien wohnen.
Trotzdem gibt es auch hier einige Erfolge.
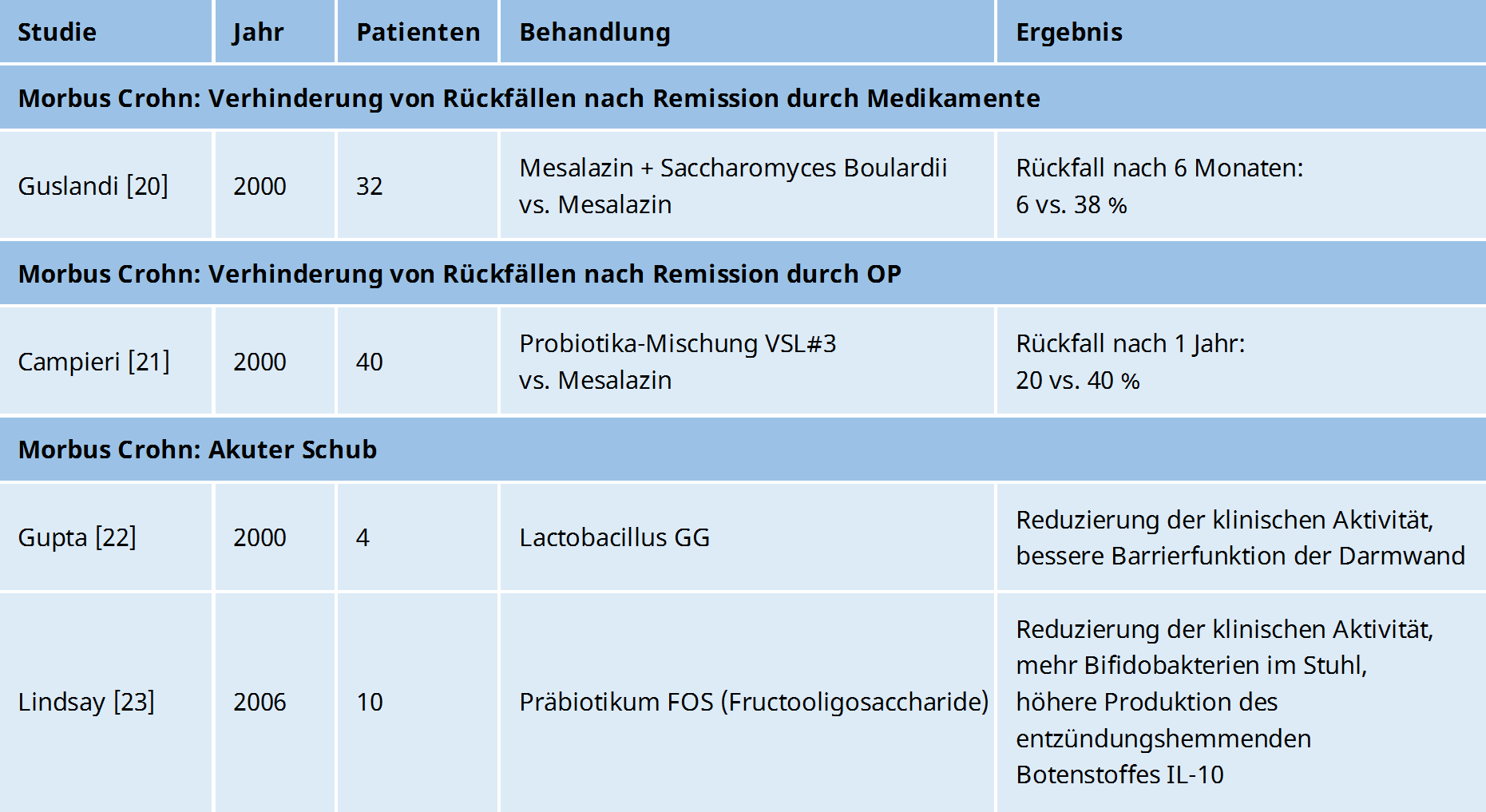
Probiotika zur Verhinderung von Rückfällen bei Morbus Crohn
Der Hefepilz Saccharomyces boulardii, der bei Colitis ulcerosa im Schub so effektiv war, hat in einer Studie von 2000 dafür gesorgt, dass Morbus Crohn-Patienten, die durch Medikamente in einer Remission waren, deutlich seltener einen Rückfall erlitten.20
Von 32 Patienten wurde ein Teil mit 2 g Mesalazin und 1 g Saccharomyces boulardii behandelt, während der andere Teil nur 3 g Mesalazin erhielt.
Nach 6 Monaten hatten nur 6 % Patienten in der Hefepilz-Gruppe einen Rückfall, während es in der Mesalazin-Gruppe 38 % waren.
Die Autoren gehen davon aus, dass der Hefepilz Saccharomyces boulardii ein nützliches Hilfsmittel bei der Remissionserhaltung von Morbus Crohn sein könnte. Aufgrund der Kosten für das Produkt fordern sie aber eine Bestätigung der Ergebnisse durch weitere Studien.
Das sich die Autoren mehr um die Kosten, als um die Wirksamkeit des Hefepilzes Sorgen machen, hat mich gewundert.
Saccharomyces boulardii ist z. B. in dem Produkt Perenterol forte enthalten und die Dosis der Studie für einen Monat kostet nur ca. 60 Euro.
Wenn man bei Morbus Crohn damit tatsächlich einen Rückfall verhindern könnte, sollte es doch nicht an den Kosten scheitern — gerade wenn man die Kosten und Nebenwirkungen der Alternativen, wie Humira, Remicade oder Entyvio, bedenkt.
Aber vermutlich könnten damit die Pharmakonzerne kein Geld verdienen…
In einer weiteren Studie wurde auch für Morbus Crohn die Wirksamkeit des Probiotikums VSL#3 getestet.21
Nachdem 40 Patienten mit Morbus Crohn nach einer OP in Remission waren, bekam der eine Teil erst für 3 Monate täglich 1,8 g des Antibiotikums Rifaximin und dann für 9 Monate 6 g VSL#3 (= 1,8 x 1012 Bakterien), während der andere Teil für 12 Monate 4 g Mesalazin erhielt.
Nach 1 Jahr hatten in der Antibiotika-/Probiotika-Gruppe nur 20 % der Patienten einen Rückfall, während es in der Mesalazin-Gruppe mit 40 % deutlich mehr waren.
Die Studie ist ein Hinweis darauf, dass VSL#3 nicht nur bei Colitis, sondern auch bei Morbus Crohn Rückfälle verhindern könnte. Es gibt aber bis heute keine weiteren Studie, die dieses Ergebnis bestätigen.
Probiotika zur Behandlung eines akuten Schubs bei Morbus Crohn
In einer Pilotstudie bekamen 4 Kinder mit mild bis moderat aktivem Morbus Crohn 2x täglich Tabletten mit dem Bakterienstamm Lactobacillus GG (1010 Bakterien = 10 Milliarden) für 6 Monate.22
Schon nach 4 Wochen war die Krankheitsaktivität um 73 % niedriger und gleichzeitig verbesserte sich die Durchlässigkeit der Darmwand.
Da dies nur eine Pilotstudie war, müssen aber noch randomisierte und placebo-kontrollierte Studien durchgeführt werden, um das Ergebnis zu bestätigen.
In einer Studie von 2006 untersuchte man, welchen Effekt das Präbiotikum FOS (Fructooligosaccharide) auf das Immunsystem von Patienten mit Morbus Crohn hat.23
Da man im Reaganzglas bereits nachgewiesen hatte, dass Bifidobakterien die dendritischen Zellen des Immunystems dazu anregen den entzündungshemmenden Botenstoff IL-10 zu produzieren und FOS als Nahrung für Bifidobakterien dienen, wollte man nun wissen, ob die Einnahme von FOS auf diesem Weg die Entzündung verringern kann.
Dazu gab man 10 Patienten mit aktivem Morbus Crohn für 3 Wochen 15 g FOS.
Und tatsächlich konnte man nachweisen, dass die Bifidobakterien im Stuhl deutlich anstiegen und mehr dendritische Zellen den entzündungshemmenden Botenstoff IL-10 produzierten.
Auch hier handelte es sich nur um eine kleine Pilotstudie. Aber aufgrund der positiven Ergebnisse fordern die Autoren weitere Studien zu dem Präbiotikum FOS.
Fazit
Die aktuelle Studienlage zeigt, dass die Darmflora bei chronischen Darmentzündungen eine sehr wichtige Rolle spielt.
Die Erfolge bei der Therapie mit Probiotika waren vor allem bei Colitis und Pouchitis so überzeugend, dass die Einnahme des Probiotikums VSL#3 sogar in offiziellen Leitlinien empfohlen wird.
Bei Morbus Crohn sind die Ergebnisse nicht so eindeutig, aber auch hier machen die ersten Erfolge Mut, dass in Zukunft die Therapie durch den Einsatz von Präbiotika und Probiotika verbessert werden kann.
Mich hat vor allem überrascht, dass immer wieder die Probiotika-Mischung VSL#3 sehr erfolgreich war.
Ich kannte das Produkt vorher nicht und als ich mich näher informiert habe, ist mir aufgefallen, dass es im Vergleich zu anderen Produkten eine viel größere Anzahl an probiotischen Bakterien enthält. Vielleicht liegt darin das Geheimnis für die sehr gute Wirksamkeit in Studien.
Falls Du selbst gute oder schlechte Erfahrungen mit Probiotika gemacht hast, ein bestimmtes Probiotikum empfehlen kannst oder noch zusätzliche Infos zum Thema hast, schreib‘ mir einfach eine Mail oder hinterlasse einen Kommentar.
Ich werde diesen Artikel immer wieder aktualisieren, wenn ich etwas Neues zum Thema Probiotika bei CED erfahre.
Quellen:
- 1 Matijašić M et al., Modulating Composition and Metabolic Activity of the Gut Microbiota in IBD Patients, Int J Mol Sci. 2016, (Modulation der Zusammensetzung und Stoffwechselaktivität der Darmflora von Patienten mit chronisch-entzündlichen Darmerkrankungen)
- 2 Hoffmann J et al., Chronisch entzündliche Darmerkrankungen: Handbuch für Klinik und Praxis, Georg Thieme Verlag KG, 2009
- 3 Sartor RB, Microbial Influences in Inflammatory Bowel Diseases, Gastroenterology, Februar 2008, (Mikrobielle Einflüsse bei Chronisch-entzündlichen Darmerkrankungen)
- 4 www.deutschlandfunk.de, MAP-Bakterium gibt immer noch Rätsel auf
- 5 Strober W, Adherent-invasive E. coli in Crohn disease: bacterial „agent provocateur“, J Clin Invest. 2011, (Adherent-invasive E. coli bei Morbus Crohn: Bakterieller „agent provocateur“)
- 6 www.dccv.de, Barrierestörung des Darms
- 7 Sheil B et al., Probiotic Effects on Inflammatory Bowel Disease, J. Nutr., März 2007, (Probiotische Effekte bei chronisch-entzündlichen Darmerkrankungen)
- 8 Venturi et al., Impact on the composition of the faecal flora by a new probiotic preparation: Preliminary data on maintenance treatment of patients with ulcerative colitis, Aliment Pharmacol Ther 1999, (Die Wirkung auf die Zusammensetzung der Fäkalflora durch ein neues Probiotika-Präparat: Vorläufige Daten über die Remissionserhaltung bei Patienten mit Colitis ulcerosa)
- 9 Ishikawa H et al., Randomized controlled trial of the effect of bifidobacteria-fermented milk on ulcerative colitis, J Am Coll Nutr 2003, (Randomisierte kontrollierte Studie über den Effekt von Bifidobakterien-fermentierter Milch bei Colitis ulcerosa)
- 10 Kruis W et al., Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine, Gut 2004, (Remissionserhaltung bei Colitis ulcerosa mit dem Probiotikum Escherichia coli ist genauso effektiv, wie die Standardbehandlung mit Mesalazin)
- 11 Guslandi M et al., A pilot trial of Saccharomyces boulardii in ulcerative colitis, Eur J Gastroenterol Hepatol 2003, (Eine Pilotstudie über Saccharomyces boulardii bei Colitis ulcerosa)
- 12 Borody TJ et al., Treatment of ulcerative colitis using fecal bacteriotherapy, J Clin Gastroenterol 2003, (Behandlung der Colitis ulcerosa mit fäkaler Bakterientherapie)
- 13 Sood A et al., The probiotic preparation, VSL#3 induces remission in patients with mild-to-moderately active ulcerative colitis., Clin Gastroenterol Hepatol 2009, (Die probiotische Zubereitung VSL#3 führt Remission bei Patienten mit mild-bis-moderater aktiver Colitis ulcerosa herbei)
- 14 Tursi A et al., Treatment of relapsing mild-to-moderate ulcerative colitis with the probiotic VSL#3 as adjunctive to a standard pharmaceutical treatment: a double-blind, randomized, placebo-controlled study., Am J Gastroenterol 2010, (Behandlung der rezidivierenden, milden-bis-moderaten Colitis ulcerosa mit dem Probiotikum VSL#3 in Verbindung mit einer pharmazeutischen Standardbehandlung: Eine doppelblinde, randomisierte, placebo-kontrollierte Studie.)
- 15 Gionchetti P et al., Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: A double-blind, placebo-controlled trial, Gastroenterol 2000, (Orale Bakterien-Therapie in der Remissionserhaltungstherapie bei Patienten mit chronischer Pouchitis)
- 16 Mimura T et al., Once-daily high-dose probiotic therapy (VSL#3) for maintaining remission in recurrent or refractory pouchitis, Gut 2004, (Einmaltägliche Hochdosis-Probiotika-Therapie (VSL#3) für die Remissionserhaltung bei wiederkehrender oder refraktärer Pouchitis)
- 17 Gionchetti et al., Prophylaxis of pouchitis onset with probiotic therapy: A double-blind, placebo-controlled trial, Gastroenterol 2003, ( Prophylaxe des Pouchitis-Ausbruchs mit einer Probiotika-Therapie: Eine doppelblinde, placebokontrollierte Studie)
- 18 Gosselink MP et al., Delay of the first onset of pouchitis by oral intake of the probiotic strain Lactobacillus rhamnosus GG, Dis Colon Rectum 2004, Verzögerung des ersten Ausbruchs einer Pouchitis durch die orale Einnahme des Probiotika-Stammes Lactobacillus rhamnosus GG)
- 19 Gionchetti et al., High-dose probiotics for the treatment of active pouchitis, Dis Colon Rectum 2007, (Hochdosierte Probiotika für die Behandlung der aktiven Pouchitis)
- 20 Guslandi M et al., Saccharomyces boulardii in maintenance treatment of Crohn’s disease, Dig Dis Sci 2000, (Saccharomyces boulardii in der Remissionserhaltung bei Morbus Crohn)
- 21 Campieri M et al., Combination of antibiotic and probiotic treatment is efficacious in prophylaxis of postoperative recurrence of Crohn’s disease: A randomized controlled study versus mesalamine, Gastroenterol 2000, (Kombination einer antibiotischen und probiotischen Behandlung ist effektiv in der Prophylaxe der postoperativen Rückkehr von Morbus Crohn: Eine randomisierte kontrollierte Studie gegen Mesalazin)
- 22 Gupta P et al., Is lactobacillus GG helpful in children with Crohn’s disease? Results of a preliminary open-label study, J Pediatr Gastroenterol Nutr 2000, (Ist Lactobacillus GG hilfreich bei Kindern mit Morbus Crohn? Ergebnisse einer vorläufigen, offenen Studie)
- 23 Lindsay JO et al., Clinical, microbiological and immunological effects of fructo-oligosaccharide in patients with Crohn’s disease, Gut 2006, (Klinische, mikrobiologische und immunologische Effekte von Fructo-Oligosacchariden in Patienten mit Morbus Crohn)
- 24 Sjögren YM et al., Influence of early gut microbiota on the maturation of childhood mucosal and systemic immune responses., Clin Exp Allergy 2009, (Einfluss der frühen Darmflora auf die Reifung des kindlichen Schleimhaut- und systemischen Immunsystems)